自2022年5月,猴痘病毒(monkeypox virus, MPXV)爆发导致全球115个国家出现超90000病例,尽管这种典型的人畜共患疾病多年来一直在西非和中非流行,但此次疫情规模前所未有,WHO于2022年7月宣布其为国际关注的突发公共卫生事件。MPXV属于正痘病毒属成员,该属还包括人们熟知的天花病毒,2022年的爆发主要由IIb型MPXV驱动,多与不太严重的症状相关,而次年刚果民主共和国报告的第二次大规模爆发则由I型MPXV感染引起,多具有致命性【1, 2】。
正痘病毒为双链DNA病毒,抗原之间具有高度相似性,因此疫苗可提供对该属内其他病毒的交叉保护性免疫力。早期痘苗病毒(VACV)的接种已彻底消灭肆虐千年的天花病毒,同时也能对MPXV提供强大而持久的保护,目前使用的第三代正痘病毒疫苗是基于改良的安卡拉痘苗病毒(MVA),即非复制型VACV衍生物,2022年猴痘爆发期间,接受完整两剂MVA的个体中,疫苗有效性仅为66%,且抗体反应在两年内迅速减弱【3-5】。因此,需要开发出一种新型、有效、持久、安全且能快速大规模生产的疫苗。
2024年2月15日,来自美国BioNTech的Asaf Poran团队等在Cell杂志上合作发表了一篇题为A multivalent mRNA monkeypox virus vaccine (BNT166) protects mice and macaques from orthopoxvirus disease的文章,他们针对2022-2023年全球爆发的猴痘疫情设计处一种具有高免疫原性、安全性的多价mRNA疫苗BNT166,并在多种临床前模型中证实其功效,支持其在临床试验中的进一步评估。

猴痘病毒存在包膜病毒(EV)和成熟病毒(MV)两类病毒颗粒,每种均有一组独特的表面抗原【5】,该团队据此设计出靶向IIb型MPXV的EV(A35和B6)和MV(M1和H3)抗原的mRNA疫苗BNT166,并评估两种候选组合疫苗:四价BNT166a(针对所有4种抗原)和三价BNT166c(仅针对A35、B6和M1)的性能。BNT166疫苗mRNA能在体外细胞中成功表达并正确定位于细胞表面,且多种成分之间不会产生干扰,用BNT166a、BNT166c以及每种单组分抗原mRNA对小鼠进行肌内免疫,均能诱导淋巴结生发中心的抗原特异性B细胞以及水平相当的T细胞反应。至免疫第35天,该团队通过蚀斑减少中和试验(PRNT)和灶斑减少中和实验(FRNT)来测定VACV和MPXV的中和抗体水平,单独使用EV蛋白A35和B6免疫的小鼠血清不显示中和活性,用单独的MV蛋白M1和H3免疫的小鼠血清可有效中和VACV和MPXV,且M1与BNT166a和BNT166c组间未观察到显著差异。
接下来,该团队利用MPXV敏感的CAST/Ei小鼠评估两种组合疫苗对MPXV的保护功效。在第0天和21天用BNT166a和BNT166c等分别进行鼻内接种,后让小鼠感染2022年爆发的MPXV株,随后第3或7天处死小鼠以测定肺部MPXV病毒滴度。结果显示,用A35和B6抗原免疫的小鼠在第3天肺部病毒滴度没有显着降低,但在第7天病毒滴度有所降低,而BNT166a和BNT166c免疫动物在任一时间点均未显示出可测量的病毒。此外,他们还进行一项针对致命性I型MPXV感染的保护性研究,两种组合疫苗均可提供100%的死亡保护,而使用A35和B6组合免疫的小鼠具有微小但显着的生存获益。除了对MPXV提供保护外,该团队还用另一种致死剂量的正痘病毒VACV感染小鼠,仅用H3免疫的小鼠迅速死于感染,而多价BNT166a或单一成分A35、B6和M1免疫的小鼠完全免于死亡,表明BNT166具有预防多种正痘病毒的潜力。
基于上述研究结果,该团队进一步在非人灵长类动物(食蟹猴)中评估BNT166的保护作用,两组食蟹猴分别在第0天和28天接受初免和加强免疫,第60天接受致死剂量I型MPXV感染,83.3%的对照组均死于感染,而接种BNT166a的动物仅表现出轻微的疾病症状如短暂的病毒血症和体重减轻。
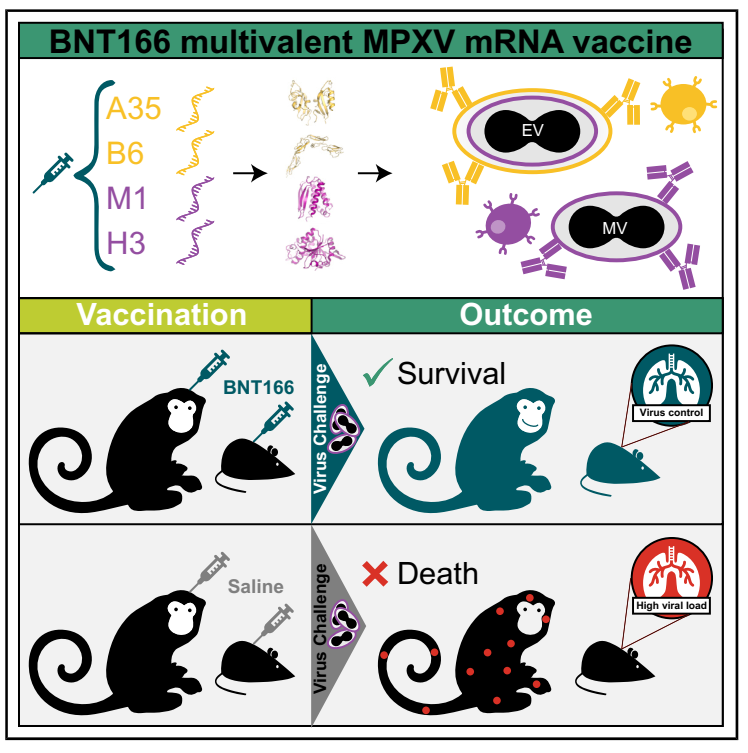
综上所述,这项工作证明编码MPXV抗原的多价mRNA疫苗BNT166具有免疫原性,并可提供对多种正痘病毒的保护性免疫,目前,BNT166的I/II期临床试验 (NCT05988203) 正在进行,以评估接种该疫苗是否可以作为缓解猴痘疫情的安全有效措施。
原文链接:https://doi.org/10.1016/j.cell.2024.01.017
参考文献
1. Organization, W.H. (2023). Disease Outbreak News; Mpox (Monkeypox) in the Democratic Republic of the Congo. Available at: https://www.who.int/emergencies/disease-outbreak-news/item/2023-DON493
2. Kibungu, E.M., Vakaniaki, E.H., Kinganda-Lusamaki, E., Kalonji-Mukendi, T., Pukuta, E., Hoff, N.A., Bogoch, I.I., Cevik, M., Gonsalves, G.S., Hensley, L.E., et al. (2024). Clade I-Associated Mpox Cases Associated with Sexual Contact, the Democratic Republic of the Congo. Emerg. Infect.Dis. 30, 172–176. https://doi.org/10.3201/eid3001.231164.
3. Overton, E.T., Lawrence, S.J., Wagner, E., Nopora, K., Ro¨ sch, S., Young, P., Schmidt, D., Kreusel, C., De Carli, S., Meyer, T.P., et al. (2018). Immunogenicity and safety of three consecutive production lots of the non replicating smallpox vaccine MVA: A randomised, double blind, placebo controlled phase III trial. PLoS One 13, e0195897. https://doi.org/10.1371/journal.pone.0195897.
4. Turner Overton, E., Schmidt, D., Vidojkovic, S., Menius, E., Nopora, K., Maclennan, J., and Weidenthaler, H. (2023). A randomized phase 3 trial to assess the immunogenicity and safety of 3 consecutively produced lots of freeze-dried MVA-BN(R) vaccine in healthy adults. Vaccine 41, 397–406. https://doi.org/10.1016/j.vaccine.2022.10.056.
5. Ilchmann, H., Samy, N., Reichhardt, D., Schmidt, D., Powell, J.D., Meyer, T.P.H., Silbernagl, G., Nichols, R., Weidenthaler, H., De Moerlooze, L., et al. (2023). One- and Two-Dose Vaccinations With Modified Vaccinia Ankara-Bavarian Nordic Induce Durable B-Cell Memory Responses Comparable to Replicating Smallpox Vaccines. J. Infect. Dis. 227, 1203–1213. https://doi.org/10.1093/infdis/jiac455.













